【北京癌症肿瘤早期诊断检测检验鉴定肿瘤标志物服务】

对付肿瘤最好的策略是早期诊断,可使治愈率提高到83%。而肿瘤早期诊断最有效的方法是通过体外诊断寻找体液中的肿瘤标志物,特别是其中的蛋白标志。
咨询电话:4001099053
恶性肿瘤是威胁人类生命健康的一类重大疾病。虽然经过科学家和临床医生的努力,肿瘤的治疗有了长足的进步,但高死亡率仍未得到有效控制。根据国家癌症中心最新一期的全国癌症统计数据(来源于2017年全国肿瘤登记中心收集汇总的全国31省市自治区肿瘤登记处2014年的恶性肿瘤登记资料)显示,全国恶性肿瘤新发病例数380.4万例,标化发病率174.0/10万,略低于世界平均水平182.3/10万。但中国癌症发病约占全球的22%,发病人数全球第一。中国癌症死亡病例超200万,约占全球的27%,标化死亡率122.2/10万,高于世界平均水平102.4/10万。
由于缺乏癌症早筛以及就诊时间偏晚等原因,中国癌症的5年生存率仅为30.9%,而发达国家普遍在70%以上。
中国发病率和死亡率前五位恶性肿瘤构成
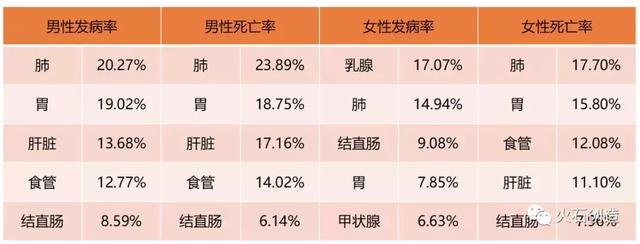
肿瘤发病机制复杂、有效筛查技术少、早期诊断技术水平低等因素导致肿瘤发现时普遍偏晚,使我国肿瘤预防形势严峻。
肿瘤标志物是指肿瘤细胞发生、增值、转移或复发过程中因肿瘤细胞的相关基因表达或集体对肿瘤发生反应而异常变化的一类物质。肿瘤标志物自发现至今已有100多年的历史,从20世纪60年代开始,其在临床上开始被广泛应用,在肿瘤的发现和治疗中发挥了重要作用。随着生物技术的发展,各种新型标志物逐渐被发现,且特异性和灵敏度不断提高。
根据临床评价标准,肿瘤标志物应有以下几个特征:
(1)必须由恶性肿瘤细胞产生,并可在血液、组织液、分泌液或肿瘤组织中检测到;
(2)在正常组织或良性肿瘤含量较低;
(3)某一肿瘤的肿瘤标志物能在罹患该肿瘤的大多数患者中检测出来;
(4)临床上尚无明确肿瘤诊断之前就能检出;
(5)肿瘤标志物的量能反映肿瘤的大小;
(6)在一定程度上能有助于估计治疗效果、预测肿瘤的复发和转移。
总体来说,临床常见的肿瘤标志物主要有以下几种:
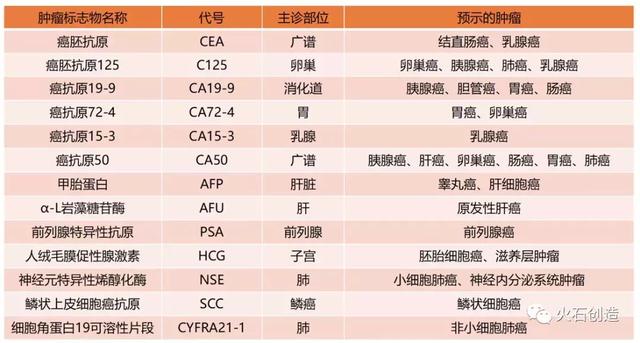
单一肿瘤标志物检测某一恶性肿瘤的准确率不高,一般不超过60%,临床上多采用多肿瘤标志物联合诊断和动态观察的方法,已达到最佳的灵敏度、特异度和准确率。以肺癌为例,NSE与ProGRP联合对小细胞肺癌诊断的灵敏度和特异度分别为88.90%和72.82%。TFGF、SCCAg、CYFRA21-1三者联合对鳞癌诊断的敏感度和特异度分别为95.30%和74.20%,均远高于单一标志物的诊断效果。
肿瘤的发生会导致细胞某些DNA水平的改变,而这些变化可以被检测。这类DNA被称为肿瘤DNA生物标志物,与常规肿瘤标志物相比更易于检出且检测时间短。常用于判断是否能使用某种单抗类或酶抑制剂类药物进行治疗,例如表皮生长因子受体(EGFR)可作为是否能使用一些EGFR络氨酸激酶抑制剂类药物的标志物。
肿瘤干细胞的概念于2001年被正式提出,具有自我更新、多分化潜力、高增值能力、耐药性等特点。除了与干细胞拥有许多共同的细胞表面抗原标记外,肿瘤干细胞还有一些特异的细胞表面抗原标记,这些标记通常与恶性肿瘤中致癌、转移、复发相关的标记相似,与肿瘤发生、发展、转移及复发有关。常见的肿瘤干细胞标志物有CD34+/CD34-/CD133/CD44-/BLBP+/CK7/CK19等。
作为当前肿瘤学研究的热点之一,肿瘤标志物还存在着明显的缺陷:
(1)灵敏度和特异度不高,存在漏诊和误诊的可能;
(2)检测费用高,联合诊断在普通查体中难以普及;
(3)某些肿瘤的特异性标志物扔不明确,在临床中难以识别。
未来肿瘤标志物的将针对各种肿瘤都达到极高的早期诊断率,能够准确预测病人肿瘤转移的预后和生存期。通过各种技术手段,发现更多更有效的肿瘤标志物,在肿瘤预防、诊断和预后中发挥重要作用。
癌症患者如果能早期发现,自愈率可大幅度提高。如何早期发现,准确的诊断、及时有效的治疗是肿瘤诊治中面临的关键问题。
——世界卫生组织
在目前的临床中,病理切片诊断是肿瘤诊断的金标准。此外,传统的影像学检查也在一定程度上提供了诊断依据。近年来,随着对肿瘤的病因和发病机制的认识以及检测技术的进步,新的肿瘤标志物不断应用于临床。肿瘤标志物在肿瘤诊疗中的应用一般根据其浓度的动态变化来辅助肿瘤的诊断和治疗。
血液和其他体液中的肿瘤标志物浓度受到不同因素的影响,主要包括:
(1)产生肿瘤标志物的肿瘤细胞的总量、肿瘤的质量、肿瘤的扩散以及肿瘤的分级;
(2)肿瘤标志物的合成速度;
(3)肿瘤细胞或细胞表面的肿瘤标志物释放速度;
(4)个别肿瘤不携带或不表达肿瘤标志物,非分泌型肿瘤虽然表达肿瘤标志物但不释放人体液中;
(5)如果肿瘤的血液供应较差,到达血循环的肿瘤标志物较少;
(6)大量肿瘤细胞崩解可引起肿瘤标志物浓度的增加,使肿瘤标志物的浓度与肿瘤的大小明显不成比例;
(7)如果集体出现代谢障碍,如肝肾功能衰竭,某些肿瘤标志物浓度不成比例的升高。
现今所知的肿瘤标志物中,虽然绝大多数不仅存在于恶性肿瘤中,也存在于良性肿瘤、胚胎组织,甚至正常组织中,但其浓度在恶性肿瘤患者中明显增多,所以肿瘤标志物的动态监测在一定程度上能有助于评价治疗效果、预测肿瘤的复发和转移。因此肿瘤标志物广泛应用于癌症的早期诊断,是一种反复,无创,简便,快捷的检测手段。如何准确可靠的检测肿瘤标志物是肿瘤筛查、诊断、预后评估、疗效监测、复发预测的重要指标。
目前肿瘤标志物的检测方法主要有放射免疫分析法、酶联免疫分析法、荧光免疫分析法、化学发光免疫分析法、蛋白质免疫印迹法、核酸分子杂交技术、聚合酶链反应(PCR)、蛋白质芯片技术等。
放射免疫分析法
放射免疫分析在20世纪50年代创建,基于标记抗原和未标记抗原相互竞争特异性抗体结合位点,形成抗原抗体复合物,根据复合物放射性强度的变化得出未标记的抗原量。无论是对疾病的诊断还是对治疗的监测,就灵敏度、精确度、适用性以及操作性而言,放射免疫分析法技术优于大多数同类分析方法,极大地促进了内分泌生理学研究。但该技术所用试剂具有放射性,对操作人员具有一定危害,同时试剂存在半衰期,试剂需在短期内使用完。
酶联免疫分析法
酶联免疫分析法是荷兰科学家Van Weeman 等于1971年发明的一项对抗体或附着于固相孔板中的抗原进行简单而快速检测和定量的有效方法。该技术利用酶联抗体与表面附着的抗原结合,添加酶作用物以产生与原始样品中存在的抗原量相关的颜色变化或光信号,根据待测物的浓度与颜色深浅的变化呈正相关得出检测结果。酶联免疫分析法灵敏度高,可用普通分光光度计检测,但易出现假阴性和假阳性且需要对结果及时解读,无法重复测量。
荧光免疫分析法
荧光免疫分析法的标记物由镧系元素通过一定的链接剂与抗体蛋白相连而成,待测物通过免疫反应形成的复合物上带有镧系元素,该元素经紫外线激发后发出长波荧光,荧光强度与待测物浓度相关。荧光免疫分析法信号强,可反复激发荧光信号,但标记物和荧光增强剂制备难度大,且荧光增强剂常含有有毒物质。
化学发光免疫分析法
化学发光免疫分析法是由化学发光系统与免疫反应系统相互结合形成的,是目前世界主流的先进免疫分析技术。通过具有化学发光性能的物质所标记的抗体(抗原)与特异性的抗原(抗体)发生特异性结合,伴随着呈现游离状态的化学发光物与该体系中的其他物质发生化学反应而发光,待测物浓度可以根据光强度得出相应的结果。化学发光免疫分析法具有很高的灵敏度,但由于影响因素较多造成稳定性较差,发光时间短,需要严格掌握检测时间。
蛋白质免疫印迹法
蛋白质免疫印迹法是一种常规的蛋白质检测方法,已应用于临床30余年。该技术通过凝胶电泳分离出蛋白质,将其转移到固相载体上,对固定化抗原选择性免疫检测,可从复杂混合物中定性或者半定量地鉴定特定蛋白质及其分子量。该技术具有高选择性和稳定性、易制备成本低等优点。
核酸分子杂交技术
具有一定互补序列和核苷酸单链在液相或固相中按碱基互补配对原则合成异质双链。杂交的双方是待测核酸序列和探针序列,利用该技术可对特定DNA或RNA进行定性或定量检测。
聚合酶链反应(PCR)
模板DNA、引物、dNTP在DNA聚合酶作用下发生酶促聚合反应,扩增出所需目的DNA。PCR技术可用于基因突变的检测,而定量PCR则加快了突变鉴定的速度,可以进行DNA上单个位点突变的鉴定。
蛋白质芯片技术
蛋白质芯片技术根据抗原来源不同分为两种形式:一是将特定抗体固定在芯片表面,首先捕获肿瘤组织或细胞裂解液中的蛋白,在基于高通量血清学检测获得差异性或阳性蛋白,通过抗体的特异性确定抗原信息。优势在于可以分析天然抗原和天然构象表位,但这种方法依赖于抗体的个数和质量,难以获得足够的抗原库。二是重组蛋白质芯片,即将确定的重组蛋白直接固定于芯片表面,进而进行血清学筛选,能够同时满足高通量和大量样本筛选需求,但获得足够种类的重组蛋白是当前的技术瓶颈。
 肿瘤早期诊断——肿瘤标志物
肿瘤早期诊断——肿瘤标志物
目前肿瘤标志物体外诊断试剂按照三类医疗器械管理,由国家食品药品监督管理局受理审评,根据CFDA数据显示,已有百余家体外诊断生产企业涉及肿瘤标志物检测试剂的生产。
结语
随着生物技术的不断发展,肿瘤标志物的应用范围不断扩大,其不只局限用于肿瘤的肿瘤的诊断和预后判断,而是已经拓宽到肿瘤标志物的检测在肿瘤的筛查、诊断、精确分型、药物选择、疗效判定和预后预测等方面获得了巨大进展,特别是在肿瘤治疗方案的制定中,可用于肿瘤治疗药物靶点的选择、药物剂量的选择以及毒副作用的预测等。





还没有人发表评论哦 ^_^